
Su socio regulatorio y CRO en DIV y dispositivos médicos
Desde el desarrollo inicial hasta el éxito posterior a la comercialización, MDx ofrece soluciones clínicas y regulatorias impulsadas por la precisión y adaptadas a las necesidades únicas de los innovadores de MedTech.
Empresa general
MDx CRO es una organización de investigación por contrato (CRO) especializada y una consultoría regulatoria para el diagnóstico in vitro (DIV) y el dispositivo médico sectores. Con oficinas en Barcelona, Londres, Madrid y Lisboa y expertos en regulación en Europa, EE. UU. y APAC, MDx apoya a las empresas que navegan por los complejos marcos globales de IVDR, MDR, normas ISO, MHRA, marcado CE, FDA y ensayos clínicos.
Fundada por líderes con décadas de experiencia en organismos notificados, operaciones regulatorias e investigación clínica, MDx combina una estrategia de precisión con un profundo conocimiento regulatorio, brindando soporte experto desde el primer concepto hasta el éxito posterior a la comercialización.

Nuestra misión y visión
Misión
Visión
Qué hacemos
Asuntos regulatorios
Investigación clínica (servicios CRO)
Calidad y cumplimiento
Representación regulatoria
Formación
Nuestros valores
Resolvemos desafíos regulatorios complejos con soluciones prácticas y expertas.
Creemos en el éxito compartido a través de asociaciones sólidas y colaborativas.
El aprendizaje continuo y la mejora son fundamentales para nuestro servicio y nuestra gente.
Escalamos con nuestros clientes, desde empresas emergentes hasta líderes del mercado.
Diversos equipos impulsan mejores decisiones, innovación y resultados.
Carlos Galamba – CEO
Antiguo gerente técnico global de DIV y líder clínico en BSI, un organismo notificado líder y asesor de la Comisión Europea en asuntos regulatorios. Amplia experiencia en DIV de clase C/D, diagnósticos complementarios y generación de evidencia clínica.

David Tome – Presidente
Especialista en operaciones clínicas globales y estrategia regulatoria. Amplia experiencia en dispositivos médicos, diagnósticos y SaMD. Conocido por apoyar a los innovadores de MedTech a través de la ampliación y el diseño de ensayos.

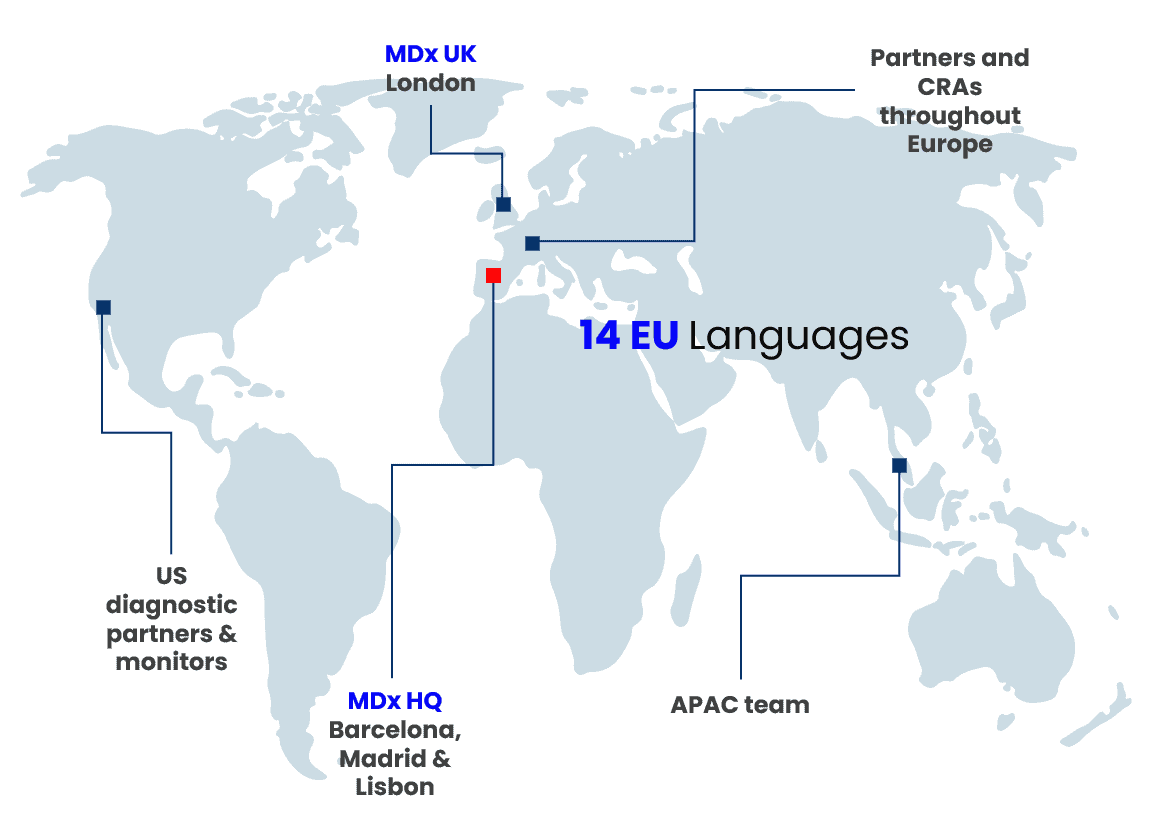
- Oficinas en Barcelona, Madrid, Lisboa y Londres
- Socios clínicos y regulatorios en UE, Reino Unido, EE. UU. y APAC
- Colaboradores con organismos notificados, asociaciones comerciales, plataforma de tecnología médica y farmacéutica (MPP) y más
- Hablamos 14 idiomas de la UE
- Representación en mercados globales clave
| Característica |
|---|
| Doble experiencia regulatoria + CRO |
| Enfoque en DIV y dispositivos |
| Representación + ejecución |
| Alcance regulatorio global |
| Ágil y escalable |
| Enlace con organismos notificados y autoridades |
| MDx CRO |
|---|

Trabaje con un socio que hable su idioma regulatorio.
MDx combina el conocimiento regulatorio experto con la excelencia clínica, lo que ayuda a los equipos de MedTech a tener éxito en cada etapa.
Precisión. Asociación. Rendimiento.


